1Debreceni Egyetem ÁOK, Belgyógyászati Intézet, Reumatológiai Tanszék, Debrecen
A hyperurikaemia és kardiovaszkuláris megbetegedések közötti összefüggés
A közelmúltban számos új eredményt közöltek a hyperurikaemia és köszvény kezelése területén. Az elmúlt években több európai és amerikai terápiás ajánlás is megszületett, amelyek pontos gyakorlati útmutatást adnak a köszvény kezelésére. Emellett ma már evidenciákon alapuló diétás, életmódi adatok is rendelkezésre állnak. A célértékre törekvő kezelés elve alapján <360 mmol/l húgysavszint elérése ajánlott.
Epidemiológiai és kísérleti vizsgálatok eredménye alapján összefüggést találtak a hyerurikaemia, illetve köszvény és a magas vérnyomás, a metabolikus szindróma, a krónikus vesebetegség és kardiovaszkuláris megbetegedés között. Számos tanulmány azt mutatja, hogy a hyperurikaemia és a köszvény független kockázati tényezői lehetnek a fenti állapotok kialakulására, ennél fogva felelősek lehetnek a köszvényes betegek megnövekedett mortalitásáért. Ebben a cikkben áttekintünk néhány tanulmányt a hiperurikaemia, illetve köszvény és ezen komorbiditások közötti kapcsolatokról, valamint az húgysavszint-csökkentő terápiák lehetséges előnyeiről hyperurikaemiás betegeknél a szív- és érrendszeri és vese kimenetelével kapcsolatban.
Kulcsszavak: hyperurikaemia, köszvény, társbetegségek, allopurinol, diéta
Connection between hyperuricaemia and cardiovascular disease.
A great amount of information has become available during past years in the area of hyperuricemia and gout. New European and American treatment recommendations have been published. These give us useful practical guidelines for the management of gout. In addition, evidence-based dietary and lifestyle recommendations have been published. According to the treat-to-target approach <360 mmol/l urate level is recommended.
Epidemiological and experimental studies have shown that hyperuricaemia and gout are linked with hypertension, metabolic syndrome, chronic kidney disease and cardiovascular disease. A number of studies suggest that hyperuricaemia and gout are independent risk factors for the development of these conditions and therefore they can be responsible for the increased mortality rate of patients with gout. In this article we review some studies about the links between hyperuricaemia, gout, and these comorbidities, and the potential benefit of urate-lowering therapies on cardiovascular and renal outcomes in patients with hyperuricaemia.
Keywords: hyperuricemia, gout, comorbidities, allopurinol, diet
Bevezetés
A köszvény megjelenése már egészen régre tehető, kutatások alapján az eddig feltárt legnagyobb T-rexről, Sue-ról is azt feltételezik, hogy köszvényben szenvedett*.
Több száz évvel ezelőtt a köszvény tipikusan a gazdag emberek betegsége volt, hiszen ők engedhették meg maguknak, hogy akár minden nap húst és bort fogyasszanak. Az egyik leghíresebb köszvényben szenvedő beteg VIII. Henrik volt (egyébként ő maga nevezte a köszvényt a királyok betegségének), akinek az 1540-ben készült portréjáról is jól látszik, hogy a köszvény mellett bizony más rizikófaktorral is rendelkezhetett komorbiditások tekintetében.
Amennyire kiváltságos megbetegedésnek számított akkor, annyira nem az most.
Az utóbbi időben történt vizsgálatok megállapítása alapján nemcsak a köszvény, de azt megelőzően meglévő hyperurikaemia már önmagában is hajlamosít kardiovaszkuláris betegségek, illetve vesebetegség kialakulására.
Definíció
Definíció szerint hyperurikaemiának a 360 mmol/l (6 mg/dl) feletti húgysavértéket nevezzük, köszvénynek pedig a hyperurikaemia következtében kialakult klinikai tünetegyüttest.
A húgysav oldódási küszöbe is 360-400 mmol/l körül van. Ezen érték felett a kristályok testszerte kicsapódnak, és tophus formájában lerakódnak. Testhőmérsékleten, azaz 37 °C-on a mononátrium-urát oldékonysága 384 mmol/l-nél éri el a határát, az oldhatóság alacsonyabb hőmérsékleten csökken. Gondoljunk itt az extremitánsokra, fülkagylóra, a tophusok leggyakoribb előfordulási helyei, ahol is a testhőmérséklet alacsonyabb, mintegy 35 °C. Itt a szaturációs küszöb már 360 mmol/l. Az oldhatóságot még több tényező is befolyásolhatja, mint pl. az ízületi folyadék egyes fehérjéi, sőt még a porcfelszín proteoglikánok is elősegíthetik a kristályképződést. A hyperurikaemia köszvény hiányában is növeli a társbetegségek rizikóját és a mortalitást. A tophus jelenléte még magasabb rizikót jelent, ezért ebben az esetben a 300 mmol/l (5 mg/dl) célértéket tartják kívánatosnak.
Az utóbbi években a rheumatoid arthritisre, spondylarthritisekre és a szisztémás lupus erythematosusra vonatkozó „treat to target” – T2T (célirányos kezelés) ajánlások mellett 2012-ben közölték a köszvényre vonatkozó ajánlást is, amely elsősorban a húgysavszinten, mint célértéken alapul, majd 2016-ban megjelent az új EULAR ajánlás is (1).
Akut roham kezelése
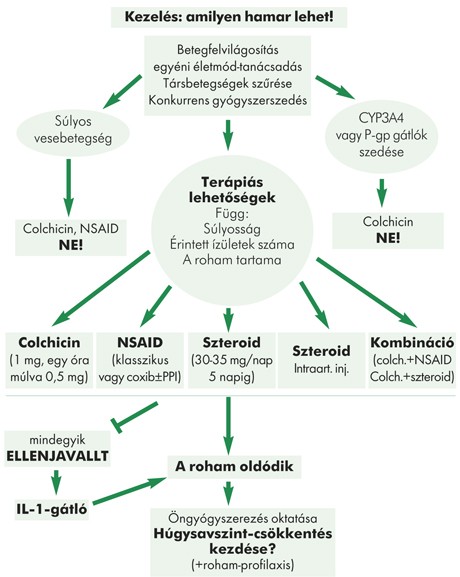
A köszvény kezelésében külön választandó az akut roham kezelése és a rohammegelőző, húgysavszintcsökkentő terápia.
Akut roham esetén a gyógyszeres kezelést minél hamarabb, lehetőség szerint 24 órán belül el kell kezdeni. Ezzel egy időben fontos a hidrálás, az ízület nyugalomba helyezése, borogatása.
Itt jegyzendő meg, hogy a korábbi elvekkel ellentétben roham jelentkezésekor a már beállított húgysavszint-csökkentő terápiát nem kell felfüggeszteni. Figyelnünk kell arra, hogy az esetlegesen társbetegségre szedett másodlagosan hyperurikaemiát okozó gyógyszerek (tiazid diuretikumok, szalicilát, ciklosporin) szedését állítsuk le.
Akut roham esetén nem szteroid gyulladáscsökkentő (NSAID), orális colchicin javasolt, vagy az előzőekre nem reagáló, illetve súlyosabb esetekben kortikoszteroid adása jön szóba. Elsőként monoterápia alkalmazandó, de súlyosabb esetben kezdeti kombináció (NSAID+colchicin, orális kortikoszteroid+colchicin, illetve NSAID/colchicin+intraarticularis kortikoszteroid) adása is megfontolandó (1. ábra).
A colchicin alkalmazása már nem a klasszikus protokoll szerint, hanem kezdetben napi 3×0,5 mg adagban javasolt a roham megszűnéséig. Hasmenés, vese- vagy májfunkciós eltérés esetén a dózist csökkenteni kell. A kisdózisú colchicin 12 órán belül bevéve ugyanolyan effektív, mint a nagy dózis, a hangsúly a korai kezelésen van. A gyakorlatban nagyon fontos a betegedukáció, a szükség esetén a terápia minél hamarabbi megkezdéséhez a rohamoldó szer mindig legyen a „beteg zsebében” (pill-in-the pocket elv).
Figyelemmel kell lenni a P-glikoprotein és CYP3A4-inhibitorokkal (cyclosporin A, clarithromycin, ketoconazol, verapamil) való interakcióra, ugyanis ezek a szerek colchicin-toxicitást okozhatnak. A súlyos vesefunkciós zavar (GFR <30 ml/perc) esetén a colchicin nem adható.
Minden szerre refrakter esetekben a gyulladásban részt vevő interleukin-1 (IL-1) elleni antitest (canakinumab) megpróbálható.
A hyperurikaemia és köszvény fenntartó gyógyszeres kezelése
Kiemelten fontos a beteg felvilágosítása, oktatása (diéta, életmód, újabb rohamok gyors oldásának megtanulása); a szekunder hyperurikaemia okainak (elhízás, alkoholfogyasztás, metabolikus szindróma, hipertónia, hyperlipidaemia, húgysavszintet emelő gyógyszerek szedése, krónikus vesebetegség, genetikai hátterű hyperurikaemiák, illetve fokozott húgysavtermeléssel járó betegségekkel, mint pl. psoriasis, malignus hematológiai kórképek) felmérése, kizárása.
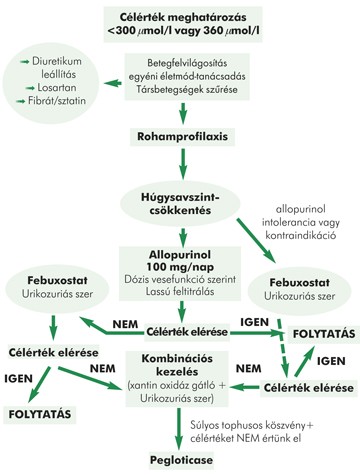
A fenntartó gyógyszeres kezelés, a fentieknek megfelelően, a T2T-elvnek megfelelően célértéken alapul. Célértékként <360 mmol/l szérum húgysavszint, súlyosabb, illetve tophusképződéssel járó esetekben <300 mmol/l elérése is indokolt lehet.
Első vonalban a húgysav termelését csökkentő xantin-oxidáz-gátló allopurinol, hatástalanság vagy mellékhatás esetén második vonalban a hasonló hatású febuxostat adása jön szóba.
Az allopurinol kezdeti dózisa 100 mg/ nap, amely fokozatosan, állandó húgysavszint-ellenőrzés mellett emelhető a kívánt határ eléréséig. Az allopurinol adagjának emelése 2-5 hetente történjen 100 mg-onként, a húgysav célértékének eléréséig; óvatos titrálással a maximális napi dózis 900 mg.
A febuxostat az allopurinolhoz hasonlóan xantin-oxidáz-gátló, az enzimet irreverzibilisen gátolja, csökkentheti a tophusok méretét is. Vese- és májbetegekben is alkalmazható, azonban szívelégtelenségben adása ellenjavallt. Adagja kezdetben napi 80 mg, ha emellett 2-4 hét múlva nem érjük el a célértéket, akkor a dózisa napi 120 mg-ra emelhető (2. ábra).
A xantin-oxidáz-gátlók ellenjavallata esetén az urikozuriás szerek jöhetnek szóba, de a probenecid és a benzbromaron hazánkban nem elérhetőek.
Vannak olyan gyógyszerek, amelyek elsődlegesen nem a köszvény terápiájában alkalmazandók, de másodlagos urikozuriás hatásuknál fogva szerepük lehet a húgysavszint-csökkentésben, mint pl. kalciumcsatorna-blokkolók, fenofibrát, atorvastatin, losartan. Tehát, ha egy köszvényes betegnek egyúttal hyperlipidaemiája, hipertóniája is ismert, akkor az említett szerek előtérbe kerülnek. Ennélfogva, hogy ezen gyógyszerek kedvezően befolyásolják a húgysavszintet, az elsődleges vaszkuloprotektív hatásuk felerősödik.
A rohamok megszűntetése után, az újabb rohamok megelőzése a célunk. A korábbi elvekkel ellentétben a húgysavszintcsökkentő kezelés már a roham idején vagy kissé később megkezdhető, illetve a már korábban megkezdett kezelés roham alatti felfüggesztése nem szükséges. A profilaxisként a colchicin az elsődleges, napi 1-2×0,5 mg fenntartó dózisban. Amennyiben a colchicin hatástalan vagy mellékhatás lép fel, alternatívaként NSAID is megpróbálható, ami egyébként profilaxis tekintetében a colchicinnel azonos hatékonyságú. Időtartama függ a köszvény súlyosságától is, kb. 3-6 hónapos roham-profilaxis javasolt.
Nem gyógyszeres kezelés
A kezelés teljes folyamatában mindvégig nagyon fontos a beteg megfelelő tájékoztatása, diétás- és életmódbeli tanácsok adása. Ezeken az alapokon múlhat akár a terápiás adherencia is.
Köszvényhez vezethetnek egyes rizikófaktorok, illetve táplálkozási tényezők, és vannak adatok arra vonatkozóan is, hogy ezek megváltoztatásával már jó eredményt érhetünk el.
Igazolták, hogy a fogyás, diéta vagy a gyomorszűkítő műtét csökkentette a húgysavszintet. Köszvény rizikóját növeli a húsfélék és alkohol túlzott fogyasztása. Egyértelműen emeli a húgysavszintet nehéz, zsíros, vörös húsok (marha, sertés, bárány), felvágottak, tenger gyümölcsei, míg ugyanez a baromfihúsra nem vonatkozik. Az alkoholos italok közül legrosszabb a sör és a tömény italok, míg a kismértékű (!) borfogyasztás kedvező hatású lehet. Újabban felismert egyértelműen káros rizikófaktor a fokozott fruktóztartalmú üdítőitalok, és az egyébként egészségesnek gondolt- cukrozott gyümölcslevek, rostoslevek.
Ami megengedett a tejtermékek (sovány tej, zsírszegény joghurt, sajt). Sőt a tej urikozuriás hatású. A szója-eredetű élelmiszerek esetében védő hatást észleltek. Az eddig nem javasolt purinban gazdag zöldségek (bab, borsó, lencse, karfiol, gomba, spenót) esetében változás történt: klinikai vizsgálatok igazolták, hogy ezen zöldségek nem fokozzák a hyperurikaemia és köszvény rizikóját. A gyümölcsök közül kiemelendő a cseresznye, mivel a benne lévő anthrocyanin ugyanis csökkenti a szérum húgysavszintet.
Érdekes vizsgálati adat, hogy a tartós kávéfogyasztás csökkentette a szérum húgysavszintet és a köszvény rizikóját. Ezt a hatást koffeinmentes kávé fogyasztása mellett is észlelték, ami arra enged következtetni, hogy a kávéban nem maga a koffein, hanem más – egyelőre – ismeretlen hatóanyag lehet felelős a húgysavszintcsökkentő hatásért. Úgy tapasztalták, hogy ezen hatás egyébként dózisfüggő, inkább nagy napi adagok (4-6 csésze) mellett volt egyértelmű.
Az életmód vonatkozásában alapvető a fogyás, optimális BMI elérése, az egészséges táplálkozás, a dohányzás abbahagyása, aktív mozgás és a jó hidratáltság (2–9).
Számos klinikai vizsgálat kimutatta, hogy a hyperurikaemia és köszvény szoros összefüggést mutat több társbetegséggel, sőt ezek kialakulására független rizikófaktorként hat.
Kardiovaszkuláris megbetegedés és mortalitás
Köszvényes betegeknél a kardiovaszkuláris megbetegedések incidenciája megnövekedett, szoros összefüggést találtak a hyperurikaemia és más komorbiditások között, mint pl. metabolikus szindróma, renalis diszfunkció és hipertenzió. Nagy epidemiológiai vizsgálatok alapján a köszvény, illetve hyperurikaemia független rizikófaktora koronária-megbetegedéseknek, perifériás keringési zavar, szívelégtelenség, stroke és kardiovaszkuláris elhalálozásnak.
A rizikó egyenesen összefüggött a húgysavszint emelkedésével, kardiovaszkuláris mortalitás is növekedett a köszvény súlyosságával.
A hyperurikaemia független rizikófaktora a magas vérnyomásnak, korábbi nagy metaanalízisek adatai alapján is. Egy kohorsz vizsgálatban 4752 fiatal felnőttet vizsgáltak, és megnövekedett rizikót találtak magas vérnyomás kialakulására magas húgysavszint esetén. Hasonló összefüggést találtak serdülőknél is egy másik vizsgálatban, mindez azt sugallja, hogy fiatal felnőttekben a magas húgysavszint serkentheti a magas vérnyomás kialakulását. Alternatív hipotézisként is szerepelhet az, hogy a hyperurikaemia a renalis diszfunkció első jele lehet, ami a későbbiekben magas vérnyomáshoz is vezethet (10).
Egy másik vizsgálatban olyan serdülőket vizsgáltak, akiknek magas volt a húgysavszintje és újonnan igazolódott hipertóniájuk. Allopurinol kezelésre a betegek 60%-nak normalizálódott a vérnyomása. Másik tanulmányban elhízott és magas vérnyomásos serdülőket vizsgáltak, akik allopurinol
(400 mg/nap) vagy probenecid (<1 g/nap) terápiát kaptak, és lényeges csökkenést tapasztaltak a vérnyomás értékekben. Azt sugallja, hogy mindez a húgysavszintcsökkentő terápiának tudható be (11, 12).
Egy japán 5 éves utánkövetéses vizsgálatban Kuwabara és munkatársai mintegy 5899 hyperurikaemiás egyénnél vizsgálták a hyperurikaemia és hipertenzió, diabetes mellitus, dyslipidaemia, kardiovaszkuláris megbetegedések, túlsúly/obesitas előfordulása közötti összefüggést. Eredményekben a hipertónia, dyslipidaemia, kardiovaszkuláris megbetegedések, obesitas megnövekedett incidenciáját észlelték, jóllehet ezt a trendet látták diabetes mellitus esetében is, bár az nem volt szignifikáns. Eredményeik alapján az aszimptomatikus hyperurikaemia szignifikáns rizikófaktorként szerepel a fenti kardiometabolikus megbetegedések kialakulására japán egyénekben, akiknél korábban ilyen megbetegedések nem fordultak elő. Ennélfogva a hyperurikaemia egyfajta biomarkere lehet a kardiovaszkuláris, illetve renalis megbetegedésnek (13).
Egy 2015-ös tanulmányban Liu és munkatársai 176 olyan 2-es típusú diabéteszes beteget vizsgáltak, akiknek hyperurikaemiájuk is volt. A betegeket két csoportra osztották: egyik csoportban allopurinol terápiát, míg másik csoportban konvencionális terápiát kaptak a betegek 3 éven keresztül. Azt tapasztalták, hogy a hosszú távú allopurinol kezelés mellett javult az inzulinrezisztencia, csökkent a CRP-szintje, csökkent a carotis intima media vastagság és csökkent ateroszklerózis kialakulása hyperurikaemiás 2-es típusú diabéteszes betegeknél (14).
Miután korábbi vizsgálatok igazolták a hyperurikaemia szerepét a hipertenzió és kardiovaszkuláris események kialakulásában, megfogalmazódott, hogy a húgysavszint talán módosítható rizikófaktor lehet a kardiovaszkuláris események tekintetében. Egy 2016-os közleményben MacIsaac és munkatársai United Kingdom Clinical Research Practice Datalink adatai alapján 2032 alloprurinollal és 2032 gyógyszeres terápiát nem kapó hyperurikaemiás betegek adatait vizsgálták 10 éves periódusban. Eredményeket tekintve az allopurinollal kezelt betegeknél alacsonyabb volt a rizikó a stroke és kardiovaszkuláris eseményekre összehasonlítva a kontrollcsoporttal. A rizikócsökkentés mértéke összefüggést mutatott a dózissal (15).
Larsen és munkatársai 4 regiszter adatai alapján vizsgálták, hogy az allopurinol terápia mennyire befolyásolhatja a kardiovaszkuláris rizikót. Azt tapasztalták, hogy az allopurinol terápia csökkentette a kardiovaszkuláris rizikót a hyperurikaemiás betegekben szemben a gyógyszeres terápiát nem kapó betegekben (16).
Diabétesz, obesitas, metabolikus szindróma
A hyperurikaemia gyakoribb elhízott, 2-es típusú cukorbetegekben és metabolikus szindrómában. Egy 2013-ban végzett metaanalízis alapján a magas húgysavszint független rizikófaktora a 2-es típusú diabétesz kialakulására. A húgysavszint emelkedésével a rizikó növekedését találták.
Fruktóztartalmú édesítők fogyasztása mellett párhuzamosan nő az obesitas prevalenciája, valamint a magas fruktózfogyasztás összefüggést mutatott a hyperurikaemiával és köszvénnyel.
Egy patkányokon történt vizsgálatban a magas fruktózfogyasztás hyperurikaemiát okozott, amelyet húgysavszintcsökkentő terápiával meg lehetett előzni, illetve mértékét enyhíteni lehetett.
Egy randomizált klinikai vizsgálatban allopurinol meggátolta a vérnyomás emelkedését magas fruktóztartalmú diétás betegeknél (5, 17, 21).
Renalis (disz)funkció
A krónikus vesemegbetegedés a köszvény rizikófaktora, de fordítva is elmondható hogy a köszvény is vezethet renalis diszfunkcióhoz. Hosszú követéses vizsgálatok igazolták, hogy a hyperurikaemia független rizikófaktora a krónikus vesebetegség kialakulásának, illetve progressziójának. A húgysav megnövekedett renintermeléshez vezethet, csökkenti az NO-termelést, interstitialis gyulladást, mikrovaszkuláris keringészavar, interstitialis fibrózis kialakulásához is vezethet.
2014-ben retrospektív kohorsz tanulmányban Levy és munkatársai vizsgálták a húgysavszintcsökkentő terápia hatását hyperurikaemiás betegnél vesebetegség progressziójára. Az adatokat Kaiser Permanente Southern California Health Plan (KPSCH) adatbázisból gyűjtötték ki. Összesen 16 186 hyperurikaemiás beteget választottak be a 3 éves követéses vizsgálatba. A betegeket 3 alcsoportra osztották: akik nem kaptak terápiát (11 192), második csoportban, akik a nyomonkövetési időtartam kevesebb, mint 80%-ában kapták a húgysavszintcsökkentő terápiát (3902), valamint akik a követési időtartam több mint 80%-ában kaptak gyógyszeres kezelést (1092). Azt tapasztalták, hogy azoknál a betegeknél, akik a terápiával elérték a kívánt <300 μmol/l (<6 mg/dl) húgysavszint-értéket, 37%-ban csökkent a renalis megbetegedések kialakulása (22).
Krónikus gyulladás szerepe
Akut köszvényes rohamok mellett bizony számolnunk kell azzal is, hogy az interkritikus periódusban szubklinikus formában fennálló gyulladás is fokozhatja a kardiovaszkuláris kockázatot. Számos megfigyelés is alátámasztotta ezt, UH, illetve kontrasztanyagos MR-vizsgálattal is kisfokú gyulladás volt kimutatható az aszimptomatikus tophus körül (23, 24).
Mortalitás
Stack és munkatársai vizsgálata megerősítette, hogy a hyperurikaemia és köszvény független tényezője az össz- és a kardiovaszkuláris mortalitásnak. Az NHANES III adatbázisban 15 700 személy adatait elemezve megállapították, hogy a kardiovaszkuláris rizikó, illetve mortalitás a húgysavszinttel korrelál. Összességében a köszvény 3,9-szeres összmortalitási és 5,3-szoros kardiovaszkuláris mortalitási rizikófokozódást eredményezett (25).
Perez-Ruiz és munkatársai is rámutatnak, hogy a terápia során elsődleges szempont, hogy a célérték figyelembevétele, a húgysavszint 360 µmol/l alá csökkentése, bár kontrollált, a mortalitási kimenetelt vizsgáló nagyobb tanulmány még nem született, a társbetegségek rizikóját is csökkenti. A hyperurikaemia köszvény hiányában is növeli a társbetegségek rizikóját és a mortalitást. A tophus jelenléte még magasabb rizikót jelent, ezért ebben az esetben a 300 mmol/l célértéket tartják kívánatosnak (26).
Kezeljük-e a hyperurikaemiát?
Ebben a tekintetben az álláspontok változóak. Mint ahogy a fenti eredményeket is láttuk, már önmaga a hyperurikaemia is összefüggésben állhat a társbetegségekkel (kardiovaszkuláris, vesebetegség), így e tekintetben ugyan indokolt lenne a húgysavszint normalizálása, bár az összefüggés nem olyan erős, mint a köszvény esetében. Néhány vizsgálat szerint a húgysav véd egyes neurodegeneratív kórképek (pl. Parkinson-kór, Alzheimer-kór) ellen, ezért a tartós hypourikaemia nemkívánatos (27, 28).
Nemzetközileg a tünetmentes hyperurikaemia gyógyszeres kezelésében még nem egységesek a kezelési ajánlások.
Következtetések
A hyperurikaemia és köszvény független rizikófaktora több egymással összefüggő kardiovaszkuláris megbetegedéseknek, illetve vesefunkció-károsodásnak. Köszvényes betegekben a hosszú távú xanthin-oxidáz-gátló terápia potenciális stratégia lehet a következményes kardiovaszkuláris, illetve vesekárosodás megelőzésében. A célérték-vezérelt terápia a komorbiditások kockázatát is csökkentheti. Húgysavszint célérték <360 mmol/l legyen, súlyosabb, tophusos köszvényben akár <300 mmol/l. Köszvény nélküli hyperurikaemia esetén még nagy betegszámú randomizált vizsgálatok szükségesek, hogy a hosszú távú húgysavszint-csökkentés jótékony hatását megerősítsék a kardiovaszkuláris, illetve vesemegbetegedések kimenetelére.
A közlemény megjelenését az Egis Gyógyszergyár Zrt. támogatta. A közleményben szereplő információk a szerző nézeteit tükrözik. Bármely említett termék alkalmazásakor az érvényes alkalmazási előírás az irányadó.
2. Zhu Y, Zhang Y, Choi HK. The serum urate-lowering impact of weight loss among men with a high cardiovascular risk profile: the Multiple Risk Factor Intervention Trial. Rheumatology (Oxford) 2010 Dec; 49(12): 2391–9. doi: 10.1093/rheumatology/keq256. Epub 2010 Aug 30.
3. Choi HK, Liu S, Curhan G. Intake of purine-rich foods, protein, and dairy products and relationship to serum levels of uric acid: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2005 Jan; 52(1): 283–9.
4. Choi HK1, Atkinson K, Karlson EW, Willett W, Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med 2004 Mar 11; 350(11): 1093–103.
5. Choi HK1, Willett W, Curhan G. Fructose-rich beverages and risk of gout in women. JAMA 2010 Nov 24; 304(20): 2270–8. doi: 10.1001/jama.2010.1638. Epub 2010 Nov
6. Choi JW1, Ford ES, Gao X, Choi HK. Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2008 Jan 15; 59(1): 109–16. doi: 10.1002/art.23245.
7. Choi HK, Curhan G. Beer, liquor, and wine consumption and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2004 Dec 15; 51(6): 1023–9.
8. Choi HK, Curhan G. Coffee, tea, and caffeine consumption and serum uric acid level: the third national health and nutrition examination survey. Arthritis Rheum 2007 Jun 15 57(5): 816–21.
9. Szekanecz Z, Paragh Gy. Hyperuricaemia: a köszvényes arthritisen túl. Magyar Reumatológia, 2011, 52, 185–190.
10. Gaffo AL1, Jacobs DR Jr, Sijtsma F, Lewis CE, Mikuls TR, Saag KG Serum urate association with hypertension in young adults: analysis from the Coronary Artery Risk Development in Young Adults cohort. Ann Rheum Dis 2013 Aug; 72(8): 1321–7. doi: 10.1136/annrheumdis-2012-201916. Epub 2012 Sep 14.
11. Gois PH1, Souza ER. Pharmacotherapy for hyperuricemia in hypertensive patients. Cochrane Database Syst Rev 2013 Jan 31; 1: CD008652. doi: 10.1002/14651858. CD008652.pub2.
12. Agarwal V1, Hans N, Messerli FH. Effect of allopurinol on blood pressure: a systematic review and meta-analysis. J Clin Hypertens (Greenwich). 2013 Jun; 15(6): 435–42. doi: 10.1111/j.1751-7176.2012.00701.x. Epub 2012 Aug 20.
13. Kuwabara M1, Niwa K2, Hisatome I2, Nakagawa T2, et al. Asymptomatic Hyperuricemia Without Comorbidities Predicts Cardiometabolic Diseases: Five-Year Japanese Cohort Study. Hypertension 2017 Jun; 69(6): 1036–1044. doi: 10.1161/HYPERTENSIONAHA.116. 08998. Epub 2017 Apr 10.
14. Liu P1, Wang H, Zhang F, Chen Y, Wang D, Wang Y. The Effects of Allopurinol on the Carotid Intima-media Thickness in Patients with Type 2 Diabetes and Asymptomatic Hyperuricemia: A Three-year Randomized Parallel-controlled Study. Intern Med 2015; 54(17): 2129–37. doi: 10.2169/internalmedicine.54.4310. Epub 2015 Sep 1.
15. MacIsaac RL1, Salatzki J2, Higgins P2, Walters MR2, et al. Allopurinol and Cardiovascular Outcomes in Adults With Hypertension. Hypertension 2016 Mar; 67(3): 535–40. doi: 10.1161/HYPERTENSIONAHA.115.06344. Epub 2016 Jan 25.
16. Larsen KS1, Pottegård A2, Lindegaard HM3, Hallas J4. Effect of Allopurinol on Cardiovascular Outcomes in Hyperuricemic Patients: A Cohort Study. Am J Med 2016 Mar; 129(3): 299–306.e2. doi: 10.1016/j.amjmed. 2015.11.003. Epub 2015 Nov 14.
17. Choi HK1, Ford ES, Li C, Curhan G. Prevalence of the metabolic syndrome in patients with gout: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2007 Feb 15; 57(1): 109–15.
18. Lv Q1, Meng XF, He FF, Chen S, et al. High serum uric acid and increased risk of type 2 diabetes: a systemic review and meta-analysis of prospective cohort studies. PLoS One 2013; 8(2): e56864. doi: 10.1371/journal.pone. 0056864. Epub 2013 Feb 20.
19. Sánchez-Lozada LG1, Tapia E, Jiménez A, et al. Fructose-induced metabolic syndrome is associated with glomerular hypertension and renal microvascular damage in rats. Am J Physiol Renal Physiol 2007 Jan; 292(1): F423–9. Epub 2006 Aug 29.
20. Perez-Pozo SE1, Schold J, Nakagawa T, Sánchez-Lozada LG, Johnson RJ, Lillo JL. Excessive fructose intake induces the features of metabolic syndrome in healthy adult men: role of uric acid in the hypertensive response. Int J Obes (Lond) 2010 Mar; 34(3): 454–61. doi: 10.1038/ijo. 2009.259. Epub 2009 Dec 22.
21. Choi HK1, Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. BMJ 2008 Feb 9; 336(7639): 309–12. doi: 10.1136/bmj. 39449.819271.BE. Epub 2008 Jan 31.
22. GD Levy, N Rashid, F Niu, TC Cheetham. Effect of urate-lowering therapies on renal disease progression in patients with hyperuricemia. The journal of Rheumatology 2014. – jrheum.org
23. Perez-Ruiz F. Treating to target: a strategy to cure gout. Rheumatology (Oxford) 2009 May; 48 Suppl 2: ii9–ii14. doi: 10.1093/rheumatology/kep087.
24. Dalbeth N, Pool B, Gamble GD, et al. Cellular characterization of the gouty tophus: a quantitative analysis. Arthritis Rheum 2010 May; 62(5): 1549–56. doi: 10.1002/art.27356.
25. Stack AG, Hanley A, Casserly LF, et al. Independent and conjoint associations of gout and hyperuricaemia with total and cardiovascular mortality. QJM 2013 Jul; 106(7): 647Casserly LF–58. doi: 10.1093/qjmed/hct083. Epub 2013 Apr 5.
26. Perez-Ruiz F, Martínez-Indart L, Carmona L, et al. Tophaceous goutand high level of hyperuricaemia are both associated with increased risk of mortality in patients with gout. Ann Rheum Dis 2014 Jan; 73(1): 177–82. doi: 10.1136/annrheumdis-2012-202421. Epub 2013 Jan 12.
27. Chen X, Wu G, Schwarzschild MA. Urate in Parkinson's disease: more than a biomarker? Curr Neurol Neurosci Rep 2012 Aug;12(4): 367–75. doi: 10.1007/s11910-012-0282-7.
28. Hershfield MS, Roberts LJ 2nd, Ganson NJ, et al. Treating gout with pegloticase, a PEGylated urate oxidase, provides insight into the importance of uric acid as an antioxidant in vivo. Proc Natl Acad Sci U S A 2010 Aug 10; 107(32): 14351–6. doi: 10.1073/pnas.1001072107. Epub 2010 Jul 26.
29. Rothschild BM, Tanke D, Carpenter K. Tyrannosaurs suffered from gout. Nature 1997 May 22; 387(6631): 357.
Cikk értékelése
| Eddig 5 felhasználó értékelte a cikket. |




Hozzászólások