1Pécsi Tudományegyetem, I. sz. Belgyógyászati Klinika, Endokrinológiai és Anyagcsere Tanszék, Pécs
A súlycsökkentő kezelések hatékonysága a nagy klinikai vizsgálatokban
A súlycsökkentést elemző nagy klinikai vizsgálatok hasznos információkat hordoznak a különböző intenzitású életmódkezelések hatékonyságára vonatkozóan is. Kiviláglik, hogy ezek önálló terápiaként – a legnagyobb erőfeszítések mellett is – erősen korlátosak, illetve az is felmérhető, hogy milyen járulékos hatásuk van a generációról generációra egyre hatékonyabb, táplálék stimulálta enterohormon-analógok mellé adva. Érdekes módon az ezen gyógyszerekkel elérhető testsúlycsökkenés relatív mértékét olyan antropometriai tényezők befolyásolják, mint az induló BMI vagy a nem, illetve olyan komorbiditások, mint pl. a T2 diabétesz. Másrészt nyitott kérdés, hogy ezen készítmények egyéb klinikai végpontokra gyakorolt pozitív hatásai mennyiben a testsúlycsökkenéstől független, pleiotróp mechanizmusok következményei.
Kulcsszavak: táplálék stimulálta enterohormon-analógok, súlycsökkentő életmódi programok, súlycsökkentő gyógyszerek, obezitológia
The effectiveness of weight-loss medications in large clinical trials.
Large clinical trials analysing weight loss also provide useful information on the effectiveness of lifestyle interventions of different intensities. It is clear that they are severely limited as stand-alone therapies, even with the greatest efforts, and it is possible to assess their incremental effects when added to the nutrient-stimulated enterohormone analogues that are becoming more and more effective generation after generation. Interestingly, the relative amount of weight loss that can be achieved with these medications is influenced by anthropometric factors such as initial BMI or gender, as well as comorbidities such as type 2 diabetes. On the other hand, it is an open question to what extent the positive effects of these drugs on other clinical endpoints are the consequence of pleiotropic mechanisms independent of weight loss.
Keywords: meal-stimulated enterohormone analogues, weight-loss lifestyle programmes, weight-loss drugs, obesity
Az életmód-változtatás testsúlyra gyakorolt hatása és a táplálék stimulálta enterohormonanalóg-terápiához hozzáadott értéke a nagy klinikai vizsgálatok tükrében
Az életmódkezelések hatékonysága közismerten erősen limitált. Így van ez a súlyfelesleg csökkentésének próbálkozásaival is. A véletlen besorolásos klinikai vizsgálatok – különösen, mivel ellenőrzött körülmények között, az átlagosnál motiváltabb betegeken történnek, magas szakmai standardok mellett – fontos adalékokat szolgáltathatnak az életmódi súlycsökkentés szerepére vonatkozóan is, így ennek viszonyáról a gyógyszeres terápiához. Ezen vizsgálatok közül a mérvadó, mérsékelt intenzitású életmódkezelést alkalmazók placeboágain a −10% középtávon (5-18 hónap) való leadásának aránya általában 15% alatti (1–13,5%) (1), illetve placebo mellett a bevontak nagy része az 5%-os súlycsökkentésre sem volt képes (a SURMOUNT-1 – számítási módszertől függő – 27,9–34,5%-os ilyen aránya kimagasló volt [2]).
Mi a helyzet a magas intenzitású életmódkezelés mellett végzett, randomizált vizsgálatokkal? A liraglutid hatásán túl, az alapellátásban alkalmazott intenzív viselkedésterápia szerepét is tesztelő SCALE IBT során a –5% elérési arány placebo mellett 38,8%-ra volt feltornázható (míg liraglutiddal 61,5% teljesítette ezt a küszöböt) (3). Érdekes összehasonlítani a vizsgálatot egy másikkal, a SCALE Obesity and Prediabetesszel (4) (1. táblázat). A SCALE IBT placeboágán nagyobb volt a súlycsökkenés mértéke, az intenzívebb életmódkezelés fölényét jelezve. Ez azonban nem jelent meg liraglutid mellett: az intenzívebb életmódkezelés nem járult hozzá extra hatással az eredményhez, és így a liraglutid specifikus effektivitása kisebbnek adódott.
Az NIH által támogatott Look AHEAD-ben a diabétesszel élők intenzív életmódkezelésével elért eredmény még nagyobb volt, mint a SCALE IBT-ben, mert itt az intervencióban részesülők 68%-a tudott legalább 5%-ot fogyni, és tartani a súlyát legalább egy évig (5). Az effektivitás hátterében az (is) állt, hogy az aktív ágon az első félévben hetenkénti konzultáció történt, majd fél évig havonta háromszor, amit csökkenő gyakorisággal négy évig követtek megerősítő foglalkozások. Azonban a későbbiekben ezt a vizsgálatot is erőteljesen sújtotta a tisztán életmódi programokra jellemző visszahízás domináns tendenciája.
Meg kell jegyezni, hogy történtek olyan – viszonylag kis esetszámú – vizsgálatok is, amelyekben életmódváltással a bevontak 90% körüli aránya volt 5% leadására képes (6, 7). Ezek közül az egyik, a SCALE Maintenance során a bevontakat táplálékhelyettesítők biztosítása és hetenkénti dietetikai megbeszélés segítette (a szokásos 1200–1400 kcal-ra korlátozott energiabevitel és heti 150 perc testmozgás tanácsa mellett) (6), a másikban pedig a Cambridge Weight Plan alacsony kalóriás diétája (800 kcal/nap) volt a módszer alapja (7). Egy harmadik, a SURMOUNT-3 során a résztvevők 82,5%-a tudta átlépni gyógyszer nélkül a −5% súlyküszöböt (8). Kérdés, hogy ezen vizsgálatok – a fenti, nagy lélekszámú tanulmányok sokkal szerényebb eredményeinek tükrében – mennyire tekinthetők reprezentatívnak.
A táplálék stimulálta enterohormon-analógok kisebb súlycsökkentő képessége detektálható bizonyos betegcsoportok, így férfiak (9–11) és T2 diabétesszel (T2DM) élők esetében. Utóbbira példa a STEP 1 (12) és STEP 2 (13) összehasonlítása. A fő különbség az volt, hogy a STEP 2 T2DM-betegek bevonásával történt; egyébként mindkettőben a súlyváltozás volt az elsődleges végpont (és nem a HbA1c, mert ha az utóbbi, a bevontak kevésbé lehetnek elkötelezettek a súlycsökkenési szándék tekintetében). Mégis, a STEP 2 esetében a gyógyszerspecifikus hatás mindössze –6,2% volt, csak feleannyi, mint a STEP 1-ben (2. táblázat), annak ellenére, hogy a STEP 2 betegeinek magas motiváltságát jelezte a – STEP 1 placeboágán elértet meghaladó – 3,4%-os átlagos fogyás a csak életmóddal kezeltek között. A két vizsgálat eredménye közti eltérést nem magyarázzák meggyőzően a betegpopulációk olyan – egyébként potenciálisan releváns – különbségei, mint hogy a STEP 2-ben a nők aránya kisebb volt (51,5% vs. 74,4%, aminek, mint fentebb láttuk, van jelentősége); magasabb volt az átlagéletkor (46,5 vs. 55,5 év), és kisebb a fehérek aránya (63% vs. 75,4%) (a koronáriabetegség gyakorisága mindkét vizsgálatban 10% alatti volt).
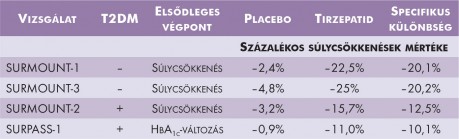
Hasonló tanulsággal szolgálnak a nagy adagú szemaglutidnál is hatékonyabb, a GLP-1-receptor-agonizmus mellett GIP-hatást is hordozó – twinkretin – molekula, a tirzepatid alkalmazásával végzett vizsgálatok is (3. táblázat). A súlycsökkenés elsődleges végpontú SURMOUNT-1 és SURMOUNT-2 esetében a placeboágon nagyobb – és a súlycsökkentő vizsgálatokra jellemző – mértékű volt a fogyás. A T2DM társulása mind a SURMOUNT-2, mind a glikémiás kontroll elsődleges végpontú SURPASS-1 esetében csökkentette a tirzepatid súlycsökkentő hatékonyságát. A SURPASS-1 placeboágának alacsony fogyási mértéke a populáció alacsonyabb motivációját is jelezheti. Ugyanakkor a tirzepatid specifikus hatása alig különbözött a két, T2DM mellett végzett vizsgálatban, a SURMOUNT-2 és SURPASS-1 esetében, ami arra utal, hogy a készítmény akkor is kifejti a súlycsökkentő hatásának zömét, ha a súlycsökkenés vonatkozásában kevéssé elkötelezettek voltak a betegek. Az is nyilvánvaló, hogy minél hatékonyabb, táplálék stimulálta enterohormon-analóggal történnek a vizsgálatok, annál nagyobb a kontraszt az életmódkezelés és a gyógyszer effektivitása között.
A T2DM ezen súlycsökkentési próbálkozással szembeni rezisztenciát okozó hatása több más vizsgálatban is kiviláglott; oka nem világos. Arra ugyanis vannak adatok, hogy T2DM esetén a glüko- és lipotoxicitás miatt a béta-sejtek és az endothel GLP-1-receptor-szintje leszabályozódik (14, 15), de a – testsúly-regulációban is szerepet játszó – központi idegrendszeri hasonló hatásokról nincs tudomásunk.
Nem tanulság nélküli összevetni a táplálék stimulálta enterohormon-analógokkal különböző intenzitású életmódváltás mellett végzett vizsgálatokat, így a STEP 1-et a STEP-program másik, STEP 3 tagjával, amely szintén a 2,4 mg/hét szemaglutid hatását elemezte (16). A bevont betegek nagyon hasonlóak voltak: mindkettőt diabétesszel nem terhelt, átlagban 46 éves életkorú, 103–107 kg átlagos induló súlyú, dominálóan fehér nők alkották, akik között ritka volt a koronáriabetegség. A fő különbség az életmódkezelés intenzitásában volt: a STEP 1 szokásos protokolljához képest (négyhetenkénti −500 kcal/nap étrendi és 150 perc/hét testmozgásfokozási tanácsadás) a STEP 3 sokkal proaktívabb volt: 8 hetes alacsonyabb energiatartalmú (1000-1200 kcal/nap) étrendet vezettek be, táplálékhelyettesítők segítségével, továbbá 200 perc/hét tanácsolt fizikai aktivitás és 30, szakértő által irányított, személyes viselkedésterápiás foglalkozás szerepelt a programban. Ennek megfelelően a STEP 1-hez képest a STEP 3-ban placebo mellett a 68. hétre a kétszerest meghaladó volt a fogyás mértéke (2. táblázat). Ugyanakkor a STEP 3-ban már a vizsgálat alatt is nagyobb mértékű volt a visszahízás a csak életmódi ágon: 32. hétnél az átlagos súlycsökkenés a 8%-ot is meghaladta, amiből a 68. hétre csak −5,7% maradt. Ezzel szemben a STEP 1 68 hetes –2,4%-os eredménye 1 kg-nál kisebb visszahízás mellett teljesült a placeboágon. A STEP 1-ben a szemaglutid hozzáadott értéke lényegesen nagyobb volt, különösen annak tükrében, hogy milyenek voltak a csak életmódhoz képest a súlyküszöbök elérésének esélyhányadosai: a legalább 15%-os fogyás a STEP 1-ben 19,3-szer nagyobb valószínűséggel következett be szemaglutiddal, mint placebóval, míg a STEP 3-ban ez az érték csak 7,9 volt. Más szóval a szemaglutid (csaknem) teljesen kiváltotta a nagyobb intenzitású életmódkezelés hatását, miközben a – potenciális kockázatot hordozó – súlyhullámzás kisebb volt. Ez azt is jelenti, hogy mivel a készítmény költsége ugyanaz, a kétféle kezelési stratégia közül a kisebb intenzitású életmód-terápiás költséghatékonyabb.
Két olyan vizsgálat, a SURMOUNT-3 és a SURMOUNT-1, amelyek a tirzepatid hasonló adagjával, de intenzív vagy kevésbé erélyes (standard) életmódkezelés mellett született eredményeinek összevetése kissé eltérő következtetések levonására ad lehetőséget (3. táblázat). A SURMOUNT-3-ban a gyógyszer (robusztus) hatásához hozzáadódott az intenzívebb életmódkezelés hatása. Nem lehet azonban figyelmen kívül hagyni, hogy mint fentebb jellemeztük, különösen elkötelezett betegeket randomizáltak. Egyébként már a vizsgálati fázisban itt is jelentős volt a placebo melletti visszahízás (itt 30%-os mértékű) és az aktív ágon a SURMOUNT-1-hez képest gyakoribb lett a gasztrointesztinális mellékhatás.
A fogyás iránti elkötelezettség hatásossága szempontjából is figyelemre méltó a STEP-1-hez az antropometriai paraméterek tekintetében nagyban hasonlatos SELECT – sikeres – kardiovaszkuláris vizsgálat. Itt a 2,4 mg/hét sc. szemaglutid –8,5%-os specifikus súlykülönbséget eredményezett, ami azért jelentős, mert hangsúlyos életmódkezelés nem történt, és az elsődleges cél nem a súlycsökkenés volt (17) (2. táblázat). Ezeknek megfelelő volt, hogy placebo mellett csak –0,9% volt a fogyás átlagos mértéke, és mindössze 10% a legalább 5%-ot fogyók aránya. Az, hogy a szemaglutid csak a 35-nél kisebb induló BMI mellett volt szignifikánsan hatásos (afelett nem), illetve hogy abban az alcsoportban is ugyanannyit csökkent a kardiovaszkuláris események gyakorisága, ahol a súlycsökkenés az 5%-ot sem érte el (a szemaglutiddal kezeltek 38%-a) arra utal, hogy kardiovaszkuláris szempontból a készítmény pleitróp hatása dominál. A metabolikus diszfunkcióval asszociált steatohepatitis (MASH) lefolyásának táplálék stimulálta enterohormonok melletti javulása sokkal meggyőzőbben arányos a súlycsökkentő potenciállal. Meg kell jegyezni, hogy a SELECT-ben az összmortalitás is csökkent, benne a nem kardiovaszkuláris eredetű is (152/196, HR: 0,77); a vizsgálat a mellékhatások tekintetében is alapvető fontosságú információkat szolgáltatott: a pancreatitisek számszerűen ritkábbak voltak a nagy adagú szemaglutid mellett, annak ellenére, hogy az epehólyaggal kapcsolatos események száma nőtt.
A fentiek alapján kérdés, hogy milyen mértékű akaratlagos életmódváltásnak van szignifikáns additív hatása a gyógyszeres súlycsökkentésre. Figyelembe veendő az is, hogy vannak adatok arra vonatkozóan, hogy a gyógyszeres súlycsökkentés ad libitum kalóriabevitel mellett, a csökkent étvágy és a relatíve magasabb kalóriaigény következtében, életmódi megszorítások nélkül is hatékony (18). (A kérdést egy véletlen besorolásos vizsgálattal lehetne legjobban eldönteni, ahol a randomizáció a gyógyszer melletti nagy vs. kis intenzitású életmódkezelés szerint történne.)
A leghatékonyabb, GIP–GLP-1–glükagonreceptor tripla agonista retatrutiddal végzett, II. fázisú vizsgálatból az is kiderült, hogy nagyobb mértékű elhízás esetén nemcsak az abszolút, hanem a relatív súlycsökkenés is nagyobb: ha a BMI 35 felett volt, a testsúly 26,5%-ot (!) csökkent átlagban, 35 alatti BMI-nél csak 21,3%-ot (11). Ugyanakkor a placeboágon 35 feletti BMI esetén a relatív fogyás kisebb volt, mint a 35 alattiaknál (–1,5% vs. –2,7%), jelezve, hogy az elhízás életmódkezelésénének egyik korlátja az elhízás mértéke.
Következtetések
A T2DM és a férfi nem számottevően mérsékli a táplálék stimulálta enterohormon-analógok súlycsökkentő hatékonyságát. Ennek oka nem tisztázott. Ezen készítmények akkor is eredményes súlycsökkentők, ha a betegek fogyással szembeni elkötelezettsége erősen korlátos, és fordítva, a fokozott intenzitású életmódkezelés ezen gyógyszerek testsúlyra gyakorolt specifikus hatását érdemben nem fokozza vagy éppen csökkenti. Másrészt adatok vannak arra nézve, hogy a súlyfelesleg módosításától független pleiotróp mechanizmusok lehetnek felelősek (elsősorban?) a kardiovaszkuláris előnyökért.
2. Jastreboff AM, Aronne LJ, Ahmad NN, et al.; SURMOUNT-1 Investigators. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med 2022; 387: 205–216.
3. Wadden TA, Tronieri JS, Sugimoto D, et al. Liraglutide 3.0 mg and Intensive Behavioral Therapy (IBT) for Obesity in Primary Care: The SCALE IBT Randomized Controlled Trial. Obesity (Silver Spring) 2020; 28: 529–536.
4. Pi-Sunyer X, Astrup A, Fujioka K, et al.; SCALE Obesity and Prediabetes NN8022-1839 Study Group. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med 2015; 373: 11–22.
5. Look AHEAD Research Group, Wing RR, Bolin P, Brancati FL, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369: 145–54.
6. Wadden TA, Hollander P, Klein S, et al.; NN8022-1923 Investigators. Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: the SCALE Maintenance randomized study. Int J Obes (Lond) 2013; 37: 1443–51.
7. Lundgren JR, Janus C, Jensen SBK, et al. Healthy Weight Loss Maintenance with Exercise, Liraglutide, or Both Combined. N Engl J Med 2021; 384: 1719–1730.
8. Wadden TA, Chao AM, Machineni S, et al. Author Correction: Tirzepatide after intensive lifestyle intervention in adults with overweight or obesity: the SURMOUNT-3 phase 3 trial. Nat Med 2024. doi: 10.1038/s41591-024-02883-1 Epub ahead of print.
9. Rentzeperi E, Pegiou S, Koufakis T, et al. Sex differences in response to treatment with glucagon-like peptide 1 receptor agonists: opportunities for a tailored approach to diabetes and obesity care. J Pers Med 2022; 12: 454.
10. Jensterle M, Rizzo M, Janež A. Semaglutide in obesity: unmet needs in men. Diabetes Ther 2023; 14: 461–5.
11. Jastreboff AM, Kaplan LM, Frías JP, et al.; Retatrutide Phase 2 Obesity Trial Investigators. Triple-Hormone-Receptor Agonist Retatrutide for Obesity – A Phase 2 Trial. N Engl J Med 2023; 389: 514–526.
12. Wilding JPH, Batterham RL, Calanna S, et al.; STEP 1 Study Group. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med 2021; 384: 989–1002.
13. Davies M, Færch L, Jeppesen OK, et al.; STEP 2 Study Group. Semaglutide 2×4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet 2021; 397: 971–984.
14. Kaneto H, Kimura T, Shimoda M, et al. Favorable Effects of GLP-1 Receptor Agonist against Pancreatic b-Cell Glucose Toxicity and the Development of Arteriosclerosis: "The Earlier, the Better" in Therapy with Incretin-Based Medicine. Int J Mol Sci 2021; 22: 7917.
15. Kimura T, Obata A, Shimoda M, et al. Down-regulation of vascular GLP-1 receptor expression in human subjects with obesity. Sci Rep 2018; 8: 10644.
16. Wadden TA, Bailey TS, Billings LK, et al.; STEP 3 Investigators. Effect of Subcutaneous Semaglutide vs Placebo as an Adjunct to Intensive Behavioral Therapy on Body Weight in Adults With Overweight or Obesity: The STEP 3 Randomized Clinical Trial. JAMA 2021; 325: 1403–1413.
17. Lincoff AM, Brown-Frandsen K, Colhoun HM, et al.; SELECT Trial Investigators. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med 2023; 389: 2221–2232.
18. Friedrichsen M, Breitschaft A, Tadayon S, et al. The effect of semaglutide 2.4 mg once weekly on energy intake, appetite, control of eating, and gastric emptying in adults with obesity. Diabetes Obes Metab 2021; 23: 754–762.
Cikk értékelése
| Eddig 1 felhasználó értékelte a cikket. |






Hozzászólások